Hreint vatn, H2O, er ætíð klofið að hluta í jákvæðar oxóníumjónir, H3O+, og jafnmargar neikvæðar hýdroxíðjónir, OH−. ◊ 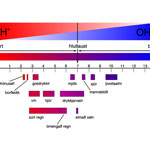
2H2O(l) 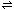 H3O+(aq) + OH−(aq)
H3O+(aq) + OH−(aq)
eða
H2O(l) 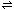 H+(aq) + OH−(aq)
H+(aq) + OH−(aq)
Í hreinu vatni er ein af hverjum 555 milljón (555 · 106) sameindum klofin. 1 lítri af hreinu 25°C heitu vatni vegur um 997 g og hvert mól H2O vegur 18 g. Þess vegna eru 997/18 = 55,4 mól vatnssameinda í einum lítra vatns. Það gerir:
55,4/555 · 106 = 1 · 10−7 mól
af klofnum vatnssameindum í hverjum lítra. Í hreinu vatni ríkir jafnvægi og oxoníumjónirnar, H3O+, eru jafnmargar og hýdroxíðjónirnar, OH−. Vatnið er hvorki súrt né basískt, (lútkennt). Raskist þetta jafnvægi verður vatnið ýmist súrt eða basískt.
Eftir því sem hýdroníumjónunum, H3O+, fjölgar súrnar vatnið. Fjöldi þeirra getur t.d. orðið 1 · 10−4 mól í lítra. Þessi ritháttur fyrir sýrustig vatns þykir óheppilegur og því er hann styttur í pH = 4. Þá stendur p fyrir neikvæðan veldisvísinn af 10 en H−ið stendur fyrir oxóníumjónirnar, H3O+, eða öllu heldur vetnisjónirnar, H+. Lausn sem mælist með pH = 7 er því hvorki súr né basísk.
Við útreikning á sýrustigi er eftirfarandi jöfnum beitt:
Kv = [H3O+] · [OH−] = 1 · 10−14 M2.
og sýrustigið er miðað við styrk oxóníumjóna í lausninni:
pH = − log [H3O+].