hlutfallareikningar, nokkur dæmi; [stoichiometry, stoicheiometry]:
| Dæmi 1: | Blanda af N2(g) og H2(g) hvarfast í lokuðu íláti og myndar ammoníak, NH3(g) samkvæmt efnajöfnunni:
N2(g) + 3 H2(g) → 2 NH3(g) Spurt er: Hversu mörg mól af NH3 fást úr 3,0 mólum af N2 og 6,0 mólum af H2? |
| Lausn: Til að auðvelda hlutfallareikninginn er best að setja upp töflu með með jöfnunni og stuðlum hennar. |
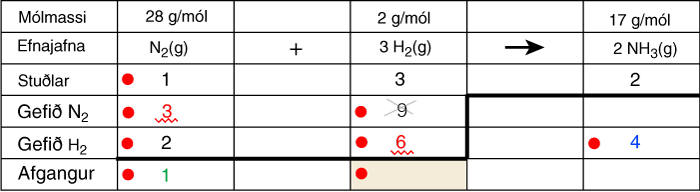 |
|
Svar: 4 mól fást af NH3(g). |
| Mólmassarnir eru hér skrifaðir inní töfluna þó þeirra sé ekki þörf í þessu dæmi. Í flestum dæmum eru hvarfefnin gefin upp í grömmum eða kílóum og þá þarf að byrja á því að reikna út mól þeirra. Sömuleiðis er oftast beðið um niðurstöðurnar í grömmum eða kílóum og þá kemur sér vel að hafa mólmassana á vísum stað. |
Sjá flóknara dæmi.